Ключевые слова: дети, аллергия, профилактика аллергии, пищевая аллергия, козье молоко, 2'-FL-олигосахарид.
Пищевая аллергия (ПА) – иммуноопосредованные реакции непереносимости пищевых продуктов, которые проявляются экзантемами (дерматиты, крапивница), симптомами поражения дыхательной системы (ринит, бронхиальная астма), желудочно-кишечного тракта, анафилаксией, ангиоотеком.
Высокая частота ПА, составляющая около 5% у детей до 5-летнего возраста и 2% у взрослых, ее существенное влияние на качество жизни, социальная значимость проблемы, решение которой требует финансовых затрат на организацию социально-бытовых условий и питания пациентов, высокая вероятность жизнеугрожающих реакций на пищу в виде анафилаксии, отека гортани и желудочно-кишечного тракта (у 40% детей с ПА) обуславливают актуальность про- филактики заболеваний, вызванных аллергией на пищу. Особое внимание уделяется пациентам с аллергическими заболеваниями, при которых частота ПА существенно выше: ПА выявляется у 30–40% детей и 20% взрослых, больных атопическим дерматитом, и у 17% больных бронхиальной астмой (1, 2).
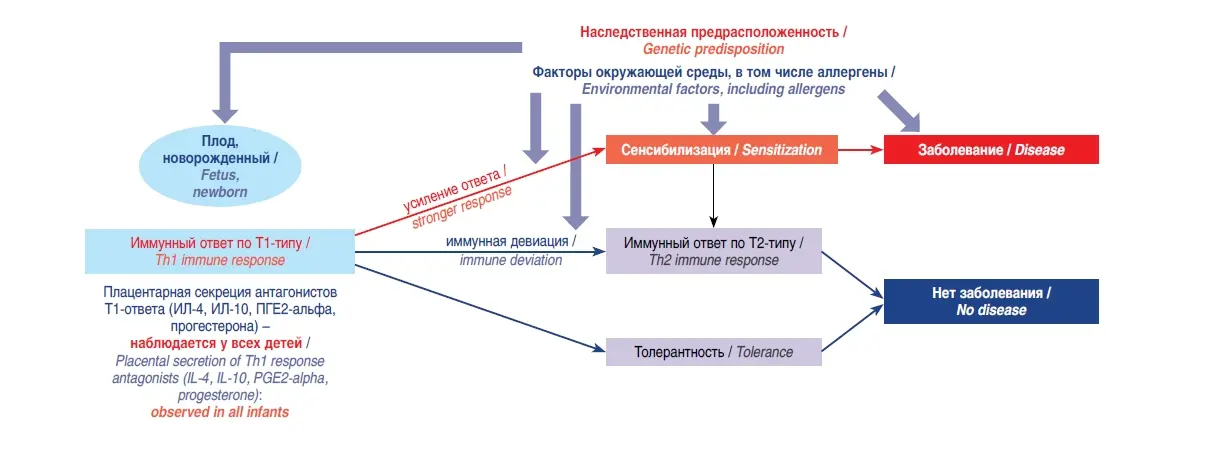
К окончанию периода внутриутробного развития у плода преобладает Т2-гуморальный иммунный ответ, который рассматривается как адаптивная защита плаценты от Т1-зависимого, клеточного иммунного ответа с возможным развитием цитотоксических реакций. Такое преобладание сохраняется в течение какого-то времени после рождения. В этот период младенец предрасположен к развитию атопии отмечается так называемый феномен «открытого окна» для внешней сенсибилизации и проявления атопических заболеваний (атопический дерматит, крапивница, аллергический ринит) (3-5). В дальнейшем, по мере созревания ребенка, происходит иммунная девиация доминирующего Т2-пути ответа на Т1-ответ либо развивается оральная толерантность, которая препятствует развитию атопического заболевания (рис. 1).
Известно более 170 аллергенных продуктов, при этом 90% всех аллергических реакций на пищу вызывают восемь из них. Это арахис, орехи, коровье молоко, соя, пшеница, куриное яйцо, рыба и моллюски. У детей наиболее частыми пищевыми аллергенами являются молоко, куриные яйца, пшеница и соя, в связи с чем исследования по профилактике пищевой аллергии фокусируются в основном на этих продуктах (4).
Профилактику аллергии можно условно разделить на первичную, направленную на предупреждение сенсибилизации, вторичную (предупреждение заболевания при наличии сенсибилизации) и третичную, которая проводится при наличии аллергии и по сути является лечением уже сформировавшегося заболевания. Некоторые авторы объединяют первичную и вторичную профилактику, обозначая их как первичную. Основу профилактики обострений заболеваний, связанных с ПА, составляет предупреждение контакта с пищевым аллергеном – элиминационная диета, принципы которой хорошо известны. Снижения порога чувствительности к аллергену при IgE-опосредованной реакции на аллерген можно достигнуть с помощью аллерген-иммунотерапии, прикоторой пациенту назначается пищевой аллерген в постепенно нарастающем количестве. Это лечение проводится оральным, подкожным, накожным и подъязычным методами и имеет существенную перспективу (5-6). В настоящее время разработаны и совершенствуются протоколы и пре- параты для терапии аллергенами арахиса, яйца, молока. Несмотря на положительные результаты, данный метод профилактики тяжелых аллергических реакций на пищу в широкую практику не внедрен, так как требует тщательного инди- видуального отбора пациентов, наличия стандартизированных лечебных аллергенов и протоколов терапии. Кроме того, лечение пищевыми аллергенами следует проводить в специализированной клинике из-за возможных серьезных побочных реакций [7, 8]. Поскольку лечение натуральными экстрактами аллергенов сопряжено с высоким риском опасных побочных эффектов, в последние годы проводится активная работа по созданию рекомбинантных аллергенов с генетическими модификациями, которые могут снизить аллергенную активность препарата при сохранении его иммуногенности, что позволяет повысить безопасность иммунотерапии [9]. С учетом иммунологических механизмов, лежащих в основе IgE-опосредованной ПА, несомненный интерес представляет исследование возможностей биологической терапии с использованием моноклональных антител, блокирующих интерлейкин-33 и IgE (omalizumab, etokimab) а также интерлейкин-4Ra (dupilumab), однако эффективность применения этих препаратов находится в стадии изучения. Данный вид профилактики острых аллергических реакций имеет особое значение для пациентов с поливалентной ПА и полиорганными атопическими заболеваниями (10-11).
Несмотря на то, что возможность первичной профилактики ПА изучается многие годы, имеющиеся ее способы ограничены и постоянно пересматриваются в зависимости от результатов исследований. Кроме того, нет общепризнанного международного консенсуса в отношении определения детей с высоким риском развития ПА, т.е. тех детей, которым целесообразно проводить профилактику (12). Описано множество возможных факторов риска ПА, к которым относятся наследственная предрасположенность; патологическое течение беременности и родов; медикаментозная терапия в период беременности; перегрузка пищевого рациона кормящих женщин молочными продуктами; снижение обе- спеченности организма ребенка витамином D; контакт пищевых аллергенов с поврежденным кожным покровом ребенка, что способствует чрескожной сенсибилизации; наличие у ребенка заболеваний желудочно-кишечного тракта, ферментопатии, нарушения микробиоценоза кишечника (13-15). Вместе с тем в настоящее время высоким риском ПА признается или атопия в анамнезе у ребенка, или наличие у ребенка родственника первой степени (по крайней мере одного родителя или родного брата/сестры) с атопическим заболеванием: астмой, аллергическим ринитом, пищевой аллергией или экземой. Роль других факторов риска обсуждается, но при решении о профилактике их учет не имеет существенного значения (16). Основными направлениями первичной профилактики ПА являются предупреждение сенсибилизации и формирование пищевой толерантности у детей группы риска. Известно, что основная роль слизистой оболочки кишечника заключается в том, чтобы служить барьером для попадания вредных веществ в пищеварительную систему и при этом селективно обеспечивать доступ необходимых питательных веществ, воды и электролитов из просвета кишечника в кровь. Несмотря на то, что пищевые антигены считаются чужеродными, они избира- тельно поступают в кровоток, не вызывая защитного иммунного ответа в кишечнике, но индуцируют иммунную толерантность, т.е. активную неотвечаемость на антигены, попадающие в организм оральным путем. Таким образом, оральная толерантность является результатом иммунорегуляторной стратегии, используемой кишечником и лимфоидными тканями для того, чтобы сделать периферическую иммунную систему нереактивной к непатогенным белкам, таким как пища или бактерии-комменсалы. Нарушение этого механизма толерантности является одним из важнейших факторов, приводящих к ПА (17).
В предыдущие десятилетия стратегия профилактики аллергии строилась на гипотезе, согласно которой «срыв» процесса формирования толерантности может быть связан с ранним контактом иммунной системы ребенка с потенциальным аллергеном или его избыточным количеством. На основании результатов ранее проведенных многочисленных исследований широкое распространение получили рекомендации, основанные на ограничении контакта ребенка, имеющего риск аллергии, с пищевыми аллергенами: элиминационные диеты беременной и кормящей матери, позднее введение продуктов, наиболее часто вызывающих аллергические реакции, замена обычных смесей для искусственного вскармливания смесями на основе гидролизата молочного белка (18, 19).
Вместе с тем результаты исследований последних лет и тщательный анализ ранее выполненных работ дали основание для пересмотра «элиминационной» стратегии профи- лактики аллергии, в связи с чем в настоящее время рекомендуется раннее введение «аллергенных» продуктов для профилактики пищевой аллергии и формирования толерантности. Более того, выявлено, что строгая элиминация аллергенов может способствовать повышению риска развития аллергических заболеваний (20-24.
В современных рекомендациях по профилактике ПА учтены результаты рандомизированных контролируемых исследований (РКИ) эффективности индукции оральной толерантности у детей раннего возраста для профилактики ПА, которые изложены в меморандумах Европейской академии аллергии и клинической иммунологии (EAACI) и рабочих групп многих стран (25). Рекомендации экспертов в отношении грудного вскармливания детей с риском аллергии согласуются с рекомендациями Всемирной организации здравоохранения, согласно которым исключительно грудное кормление целесообразно проводить до 6-месячного возраста и далее продолжать до 2 лет, дополняя его продуктами прикорма. При этом никаких ограничений в питании матери в периоде как беременности, так и лактации, несмотря на риск аллергии у ребенка, не требуется, так как не было выявлено связи ПА с питанием матери. Вместе с тем степень доказательности этой рекомендации низкая из-за небольшого числа исследований и различий в методике их проведения (26).
Существенно изменилась за последнее десятилетие тактика введения в прикорм продуктов, наиболее часто вызывающих аллергию у детей. Так, была выявлена связь между приемом коровьего молока, яйца и арахиса в возрасте ранее 6 мес. и снижением частоты аллергических реакци на эти продукты в детстве. Впоследствии в результате проводимых с 2013 г. исследований, включая РКИ, были получены убедительные доказательства эффективности раннего введения аллергенных продуктов для профилактики ПА у детей с высоким риском (16).
Целевая группа EAACI предлагает вводить хорошо проваренные куриные яйца, но не сырые или пастеризованные, как составную часть прикорма для профилактики аллергии на яйца в возрасте от 4 до 6 мес. Рекомендуется включать в питание около половины маленького яйца 2 раза в неделю: это количество определено на основании результатов исследований, которые показали, что употребление не менее 2 г яичного белка в неделю предотвращало развитие аллергии на яйца [27]. Более того, было выявлено, что даже у ребенка с экземой индукция иммунной толерантности и снижение частоты аллергии на белок яйца могут быть достигнуты с помощью раннего введения в питание этого продукта. Однако в этом случае необходимо проявлять осторожность, так как у многих детей с экземой сенсибилизация к аллергену яиц может развиться уже к 4-месячному возрасту. Рекомендации по введению яиц в питание ребенка с риском аллергии в возрасте 4–6 мес. не является абсолютной, поскольку степень ее доказательности умеренная, что связано с небольшим числом исследований и их неоднозначными результатами (28)
Также умеренную степень доказательности имеют новые рекомендации введения в питание детям с риском аллергии на арахис. В популяциях с высокой распространенностью аллергии на арахис (США, страны Западной Европы) подходящую по возрасту форму продукта рекомендуется давать детям с риском аллергии в возрасте от 4 до 11 мес. жизни, что приводит к значительному снижению частоты аллергии на этот продукт до 5-летнего возраста в сравнении с результатами его полного исключения (29). Содержащие арахис продукты следует вводить втом виде, который исключает возможность его вдохнуть или подавиться: например, рекомендуется давать одну полную чайную ложку разведенного арахисового масла, которая содержит около 2 г арахисового белка, каждую неделю (30). Рекомендации для профилактики аллергии на арахис пока не следует учитывать в странах с низкой распространенностью аллергии на этот продукт, в т.ч. в России: в этих странах арахис целесообразно включать в питание в соответствии с местными рекомендациями.
Несмотря на значительное число публикаций, в которых представлены результаты исследований возможности про- филактики аллергии с помощью витамина D, ω-3, пре- или пробиотических добавок как в питание матери в период беременности и грудного вскармливания, так и детям, име- ющим риск, в настоящее время их использование специаль- но для профилактики аллергии не рекомендуется. Низкая степень доказательности положительного результата этих работ связана с различием объема и продолжительности исследований, типа добавок, их состава, диагностических критериев. Корректная оценка результатов исследований осложняется тем, что клинические эффекты и безопасность конкретных пробиотиков или их комбинации, пребиотиков или синбиотиков не могут быть экстраполированы на другие, поскольку их иммунологическое воздействие на орга- низм различается. Вместе с тем исследования в этом направлении продолжаются, поскольку разработка данной страте- гии профилактики имеет перспективу, особенно это касается применения пребиотиков и пробиотиков (31-33). Гипотеза о влиянии чрескожной сенсибилизации пищевы- ми аллергенами на развитие аллергии у детей, особенно имеющих мутации генов синтеза филаггрина (структурного белка кожи, отвечающего за ее эластичность), послужила основанием проведения исследований, посвященных возможности профилактики аллергии и экземы у детей первого года жизни с помощью постоянного использования эмолентов – специальных лечебных средств, увлажняющих и восстанавливающих кожу благодаря способности проникать на уровень рогового слоя и гидролипидной мантии (34). Несмотря на то, что в ходе исследований не было получено убедительных доказательств эффективности применения эмолентов для профилактики атопического дерматита и ал- лергии, эти результаты могут быть связаны с различиями типа, частоты и длительности использования эмолента. Возможно, что применение смягчающих средств, обогащенных церамидами, содержащих филаггрин или белки – его предшественники, будет более эффективным (35). Таким образом, использование эмолентов специально для профилактики аллергии у детей раннего возраста с риском аллергии при отсутствии сухости кожи не рекомендуется (36).
В сравнении с предыдущими рекомендациями мнение о возможности назначения смесей на основе соевого белка детям с риском аллергии для ее профилактики не изменилось: их использование не рекомендуется, несмотря на то, что в некоторых исследованиях было выявлено снижение частоты развития аллергии на коровье молоко на фоне кормления соевыми смесями. Таким образом, данная тема исследований, несмотря на однозначные рекомендации во многих странах, остается предметом исследований. Кроме того, соевые смеси не рекомендуется использовать для кормления детей младше 4-месячного возраста из-заособенностей их состава (37).
Общей для предыдущих и настоящих рекомендаций по профилактике аллергии на белок коровьего молока является исключение кормления и докорма обычными смесями на основе цельного коровьего молока в первую неделю жизни детей, находящихся на искусственном и грудном вскармливании. Эта рекомендация основывается на немногочисленных результатах исследований, но, несмотря на противоречивые аргументы, является общепринятой. При необходимости компенсировать временный недостаток грудного молока в первую неделю жизни ребенка можно докармливать донорским грудным молоком, смесью на основе гидролизата белка или аминокислот в зависимости от клинической ситуации(38).
В предыдущих руководствах по профилактике ПА в тех случаях, когда грудное вскармливание было невозможным, рекомендовалось использовать смеси на основе частично гидролизованного молочного белка, в связи с чем эти смеси широко применялись и используются в настоящее время для искусственного вскармливания детей с риском аллергии (39, 40). Вместе с тем эта рекомендация в последние годы подвергается ревизии, так как, во-первых, при тщательном анализе ранее проведенных исследований не было обнаружено доказательств в поддержку краткосрочного или пролонгированного вскармливания гидролизованной смесью в сравнении с исключительно грудным кормлением для предотвращения атопического заболевания (41), во-вторых, результаты мета-анализа свидетельствуют о том, что смесь на основе как частично, так и высокогидролизованного белка молока не предотвращает какие-либо атопические состояния, в т.ч. ПА. Кроме того, степень доказательств того, что один тип гидролизованной формулы был более эффективным, чем другой, была незначительной. Противоречивые заключения в отношении профилактического эффекта смесей на основе белковых гидролизатов связаны с тем, что в исследованиях использовались разные продукты, которые вводились детям разного возраста, они, как правило, были недостаточными по объему и в них не всегда использовали должные диагностические критерии ПА (42).
Если ранее опубликованные рекомендации по профилактике аллергии на коровье молоко основывались на результатах исследований об отсутствии профилактического эффекта обычных молочных смесей, более того, предполагалось, что их раннее введение ребенку способствует сенсибилизации и аллергии, то в настоящее время это положение пересматривается (21). Выявлено, что повышенный риск аллергии на коровье молоко, наоборот, связан с отсроченным или нерегулярным употреблением коровьего молока в раннем возрасте. Исследователи пришли к выводу, что введение смеси на основе обычного коровьего молока после первой недели жизни не увеличивает риск аллергии в младенчестве или раннем детстве, более того, раннее воздействие белка коровьего молока в первые 3 мес. жизни снижает риск сенсибилизации (42, 43). Вместе с тем, если ребенок с риском аллергии получает молочное питание (молочную смесь или продукт прикорма), целесообразно обеспечить его регулярный прием как минимум по 10 мл в день ежедневно, чтобы предотвратить потерю толерантности, так как непостоянный прием молочной смеси может увеличить риск аллергии (44).
Таким образом, рекомендации Американской академии аллергии, астмы и иммунологии (AAAAI), Канадского общества аллергии и клинической иммунологии (CSACI), Австралазийского общества клинической иммунологии и аллергии (ASCIA), Европейской академии аллергии и клинической иммунологии (EAACI) не содержат указаний на то, что ребенок с риском аллергии при невозможности грудного вскармливания или необходимости докорма должен получать после первой недели жизни какую-либо определенную смесь: воз- можно использование как смесей на основе гидролизованного белка, так и обычных молочных заменителей грудного молока, но не соевой смеси (в первые 6 мес. жизни) (16, 25).
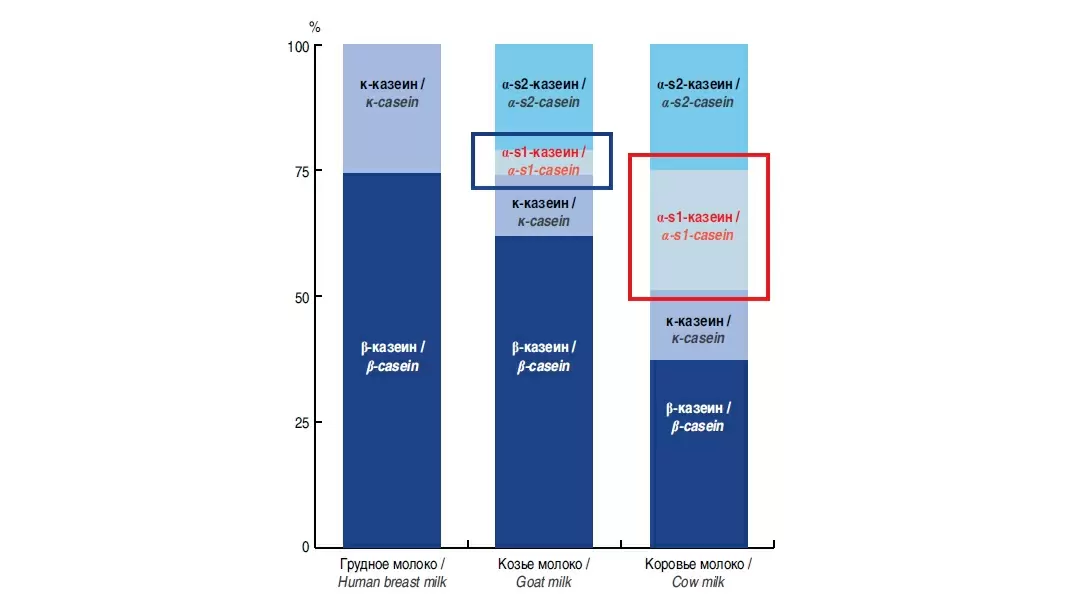
Среди заменителей грудного молока наиболее часто используются смеси на основе коровьего молока, в то время как источниками белка, разрешенными в детских смесях, являются не только коровье молоко, соя и гидролизованные белки, но и козье молоко. В 2012 г. Европейское управление по безопасности пищевых продуктов (EFSA) пришло к выводу, что козье молоко является подходящим источником белков для детских смесей, и с этого времени интерес к использованию смесей на основе козьего молока постоянно возрастает (45-47). Козье молоко содержит сравнимое с коровьим молоком количество общего белка, с немного более высоким соотношением сывороточных белков и казеинов, составляющим 84:16 по сравнению с 80:20 для коровьего молока. Более того, профиль отдельных белков различается: было показано, что козье молоко содержит значительно меньшее количество α-s1-казеина, но значительно большее количество α-s2- и β-казеина по сравнению с коровьим молоком, в то время как количество специфических сывороточных белков сопоставимо для коровьего и козьего молока. При этом белки коровьего и козьего молока обладают высокой идентичностью аминокислотной последовательности, которая колеблется от 85 до 95% (48). Такое сходство белков козьего и коровьего молока обусловливает их перекрестную аллергенную реактивность, вследствие чего лишь немногие пациенты с аллергией на коровье молоко переносят козье и наоборот. Таким образом, смеси на основе козьего молока не должны применяться в качестве заменителей грудного молока у детей с аллергией на коровье молоко (49).. Вместе с тем козье молоко имеет ряд преимуществ в сравнении с коровьим, что делает использование смесей на его основе перспективным для вскармливания не только здоровых доношенных детей, но и, возможно, детей с риском аллергии (50, 51).. Существующие результаты исследований эффекта козьего молока и смесей на его основе в отношении профилактики ПА малочисленны и степень их достоверности низкая, но контролируемые экспериментальные данные, полученные в работах с животными, свидетельствуют о том, что такой эффект возможен (52).. Кроме того, существуют следующие теоретические предпосылки исследования профилактического применения смесей на основе козьего молока. В отличие от коровьего, козье молоко имеет большее сходство с грудным молоком. Тип секреции козьего и грудного молока апокриновый, т.е. связан с разрушением секретирующих клеток, содержимое которых попадает в молоко, благодаря чему козье молоко, так же как и грудное, содержит большое количество биологически активных компонентов, важных для развития и полноценного функционирования иммунной системы ребенка. В сочетании с высоким уровнем среднецепочечных триглицеридов эта особенность козьего молока обуславливает его антиоксидантное и противовоспалительное действие за счет модуляции мононуклеарных клеток и полиморфноядерных нейтрофилов периферической крови (53).. Выявлено также, что кормление мышей козьим молоком вызывало изменение цитокинового профиля животных в сторону Т1-ответа, что характеризует меньший риск аллергических реакций: продукция спленоцитами интерлейкина-4 была ниже, а интерферона-γ – выше у мышей, получавших козье молоко, в сравнении с животными, которых кормили коровьим молоком (54).. Потенциальный профилактический эффект козьего молока может быть также связан с низким содержанием в нем казеиновой фракции белка – α-s1-казеина (рис. 2). Этот белок, который обладает высоким аллергенным потенциалом, полностью отсутствует в грудном молоке и в существенном количестве представлен в коровьем (рис. 3). Кроме того, минимальное содержание α-s1-казеина в козьем молоке обеспечивает более легкое усвоение белкового компонента (55).
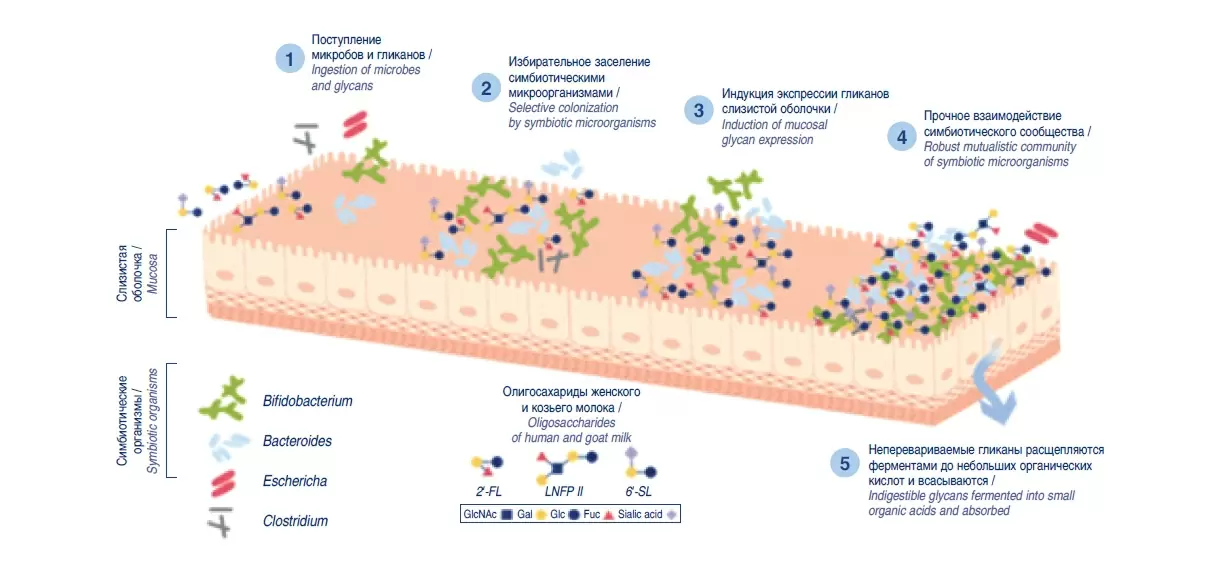
Важным преимуществом козьего молока является наличие в нем олигосахаридов, которые отсутствуют в коровьем молоке. Олигосахариды – 3-й по уровню содержания пищевой компонент грудного молока, который благодаря своим пребиотическим и противоинфекционным свойствам является основным источником колонизации микробиоты кишечника у детей раннего возраста, характер которой важен для метаболического и иммунологического развития ребенка. Грудное молоко содержит более 200 молочных олигосахаридов, которые стимулируют рост бифидобактерий, выделяющих короткоцепочечные жирные кислоты и другие метаболиты (постбиотики), что формирует состав кишечной микробиоты, предотвращает адгезию возбудителей инфекций к слизистой оболочке кишечника, снижает риск бактериальных, вирусных и паразитарных инфекций, модулирует функцию клеток иммунной системы (56). Недавние исследования показали, что среди молока всех домашних животных козье содержит самый высокий уровень олигосахаридов, которые имеют значительное сходство с олигосахаридами грудного молока. Козье молоко также содержит 2'-фукозилактозу, 3'- и 6'-галактосиллактозу, 3'- и 6'-сиалиллактозу и лакто-N-нео- тетраозу (57), которые со структурной точки зрения и так же, как и олигосахариды грудного молока, значительно усиливают рост бифидо- и лактобактерий и снижают адгезию патогенных кишечных микроорганизмов к клеткам слизистой кишечника, т.е. обладают сильными пребиотическими, антипатогенными свойствами и, возможно, играют роль в предотвращении аллергических реакций (58) (рис. 2).
Таким образом, козье молоко является перспективным альтернативным источником молочных олигосахаридов, которые можно использовать в детских смесях (59). Несмотря на определенную концентрацию олигосахаридов в козьем молоке их недостаточно для достижения уровня содержания олигосахаридов, присутствующих в женском молоке. Поэтому при производстве детских молочных смесей требуется добавление олигосахаридов для воспроизведения положительных эффектов человеческого молока.
Всеми перечисленными свойствами козьего молока, которые могут быть полезными как для здоровых детей, так и для детей из группы риска без признаков аллергии, обладает детская молочная смесь MAMAKO® Premium (ILAS, S.A.,Испания), которая полностью соответствует всем российским и европейским требованиям, предъявляемым к продуктам питания детей раннего возраста, и изготовлена на основе адаптированного козьего молока. Эта смесь является первой и единственной смесью на основе козьего молока, которая содержит не только олигосахариды козьего молока, но и инновационный компонент – пребиотик 2'-фукозиллактозу (2'-FL)-олигосахарид грудного молока в комплексе с пробиотиком Bifidobacterium lactis и «традиционным» пребиотиком – галактоолигосахаридом (GOS) (45, 60). 2’-FL- олигосахарид (2’-фукозиллактоза) относится к трисахаридам и является преобладающим компонентом грудного молока. Несмотря на то, что уникальные свойства 2'-FL-олигосахарида известны уже много лет, лишь в последние годы стало технически возможным его синтезировать и добавлять в детские смеси. Исследования показывают, что этот олигосахарид проявляет наиболее высокую биологическую активность и является многофункциональным: обеспечивает становление нормальной микрофлоры, блокирует прикрепление специфических вирусных, бактериальных, паразитарных антигенов к поверхностным сахарам эпители- альных клеток, предотвращая инфекционные заболевания кишечника, дыхательных и мочевыводящих путей, изменяет реакции эпителиальных и иммунных клеток ребенка, под- держивая развитие и регуляцию иммунитета на уровне, который обеспечивает грудное вскармливание. Кроме того, есть сообщения, что у детей с наследственной предрасположенностью к аллергии при вскармливании грудным молоком с высоким содержанием 2'-FL-олигосахарида снижается риск манифестации IgE-ассоциированной экземы до 2-летнего возраста (61, 62). Таким образом, несмотря на противо- речивые и недостаточные данные о влиянии компонентов грудного молока и смесей для искусственного вскармливания на развитие аллергии у здоровых детей и детей группы риска, исследование профилактического эффекта различных смесей, в первую очередь на основе козьего молока, содержащих 2'-FL-олигосахарид, несомненно, имеет перспективу (63).
Информация о финансировании. Финансирование данной работы не проводилось.
Подробные результаты исследования читайте в полной версии статьи в PDF
Литература
1 Burks AW, Jones SM, Boyce JA, Sicherer SH, Wood RA, Assa'ad A, et al. NIAIDsponsored 2010 guidelines for managing food allergy: applications in the pediatric population. Pediatrics. 2011 Nov;128(5):955-65. DOI: 10.1542/peds.2011-0539
2 Gupta RS, Dyer AA, Jain N, Greenhawt MJ. Childhood food allergies: current diagnosis, treatment, and management strategies. Mayo Clin Proc. 2013 May; 88(5):512-26. DOI: 10.1016/j.mayocp.2013.03.005
3 Зайцева ОВ. Инфекция и иммунитет: актуальные вопросы в практике педиатра. Детские инфекции. 2015;14(1):36-43. / Zaytseva OV. Infection and immunity: current issues in pediatric practice. Children Infections. 2015;14(1):36-43. DOI: 0.22627/2072-8107-2015-14-1-36-43 (In Russian).
4 Loh W, Tang MLK. The Epidemiology of Food Allergy in the Global Context. Int J Environ Res Public Health. 2018 Sep 18;15(9):2043. DOI: 10.3390/ijerph15092043.
5 Barshow SM, Kulis MD, Burks AW, Kim EH. Mechanisms of oral immunotherapy. Clin Exp Allergy. 2021;51(4):527-535. DOI: 10.1111/cea.13824.
6 Kazmi W, Berin MC. Oral tolerance and oral immunotherapy for food allergy: Evidence for common mechanisms? Cell Immunol. 2023 Jan;383:104650. DOI: 10.1016/j.cellimm.2022.104650
7 ones SM, Kim EH, Nadeau KC, Nowak-Wegrzyn A, Wood RA, Sampson HA, et al; Immune Tolerance Network. Efficacy and safety of oral immunotherapy in children aged 1–3 years with peanut allergy (the Immune Tolerance Network IMPACT trial): a randomised placebo-controlled study. Lancet. 2022 Jan 22;399(10322):359-371. DOI: 10.1016/S0140-6736(21)02390-4
8 Ogata M, Kido J, Nakamura K. Oral Immunotherapy for Children with Cow's Milk Allergy. Pathogens. 2021 Oct 15;10(10):1328. DOI: 10.3390/pathogens10101328
9 Valenta R, Linhart B, Swoboda I, Niederberger V. Recombinant allergens for allergenspecific immunotherapy: 10 years anniversary of immunotherapy with recombinant allergens. Allergy. 2011 Jun;66(6):775-83. DOI: 10.1111/j.1398- 9995.2011.02565.x
10 Worm M, Francuzik W, Dölle-Bierke S, Alexiou A. Use of biologics in food allergy management. Allergol Select. 2021 Feb 19;5:103-107. DOI: 10.5414/ALX02141E
11 Филиппова ЕА, Есакова НВ, Варламов ЕЕ, Пампура АН. Синдром острого энтероколита, индуцированного пищевыми белками (FPIES), как проявление множественной пищевой аллергии. Вопросы детской диетологии. 2023; 21(1):94-100. / Filippova EA, Esakova NV, Varlamov EE, Pampura AN. Clinical case of acute food-protein induced enterocolitis syndrome (FPIES) as a manifestation of multiple food allergies. Vopr. det. dietol. (Pediatric Nutrition). 2023;21(1):94-100. DOI: 10.20953/1727-5784-2023-1-94-100 (In Russian).
12 Sicherer SH, Sampson HA. Food allergy: A review and update on epidemiology, pathogenesis, diagnosis, prevention, and management. J Allergy Clin Immunol. 2018 Jan;141(1):41-58. DOI: 10.1016/j.jaci.2017.11.003
13 Приходченко НГ, Шуматова ТА, Зернова ЕС. Современные стратегии профилактики пищевой аллергии у детей. Тихоокеанский медицинский журнал. 2021;2:8-13. / Prikhodchenko NG, Shumatova TA, Zernova ES. Modern food allergy prevention strategies among children. Pacific Medical Journal. 2021;2:8-13. DOI: 10.34215/1609-1175-2021-2-8-13 (In Russian).
14 Богданова СВ, Ильенко ЛИ, Сидоров ИИ, Тарасова ОВ, Денисова СН. Профилактика и прогнозирование пищевой аллергии у детей в антенатальном и постнатальном периодах. Российский вестник перинатологии и педиатрии. 2014;59(1):34-39. / Bogdanova SV, Ilyenko LI, Sidorov II, Tarasova OV, Denisova SN. Prevention and prediction of food allergy in children in the antenatal and postnatal periods. Rossiyskiy vestnik perinatologii i pediatrii (Russian Bulletin of Perinatology and Pediatrics). 2014;59(1):34-39. (In Russian).
15 Макарова СГ, Намазова-Баранова ЛС. Обеспеченность микронутриентами и профилактика аллергии – существует ли «окно превентивной витаминизации»? (часть 1). Педиатрия. 2016;95(6):157-165. / Makarova SG, Namazova-Baranova LS. Sufficiency of micronutrients and allergy prevention – is there a «period of preventive vitaminization»? (part 1). Pediatria. 2016;95(6):157-165. (In Russian).
16 Fleischer DM, Chan ES, Venter C, Spergel JM, Abrams EM, Stukus D, et al. A Consensus Approach to the Primary Prevention of Food Allergy Through Nutrition: Guidance from the American Academy of Allergy, Asthma, and Immunology; American College of Allergy, Asthma, and Immunology; and the Canadian Society for Allergy and Clinical Immunology. J Allergy Clin Immunol Pract. 2021 Jan;9(1):22-43.e4. DOI: 10.1016/j.jaip.2020.11.002.
17 Xiong Y, Xu G, Chen M, Ma H. Intestinal Uptake and Tolerance to Food Antigens. Front Immunol. 2022 Jun 10;13:906122. DOI: 10.3389/fimmu.2022.906122.
18 Oddy WH, Peat JK, de Klerk NH. Maternal asthma, infant feeding, and the risk of asthma in childhood. J Allergy Clin Immunol. 2002 Jul;110(1):65-7. DOI: 10.1067/ mai.2002.125296
19 Hays T, Wood RA. A systematic review of the role of hydrolyzed infant formulas in allergy prevention. Arch Pediatr Adolesc Med. 2005; 159: 810-816. DOI: 10.1001/ archpedi.159.9.810
20 Новик ГА. Стратегия формирования толерантности у детей с пищевой аллергией. Вопросы современной педиатрии. 2015;14(1):70-77. / Novik GA. Strategy of food tolerance development in children with food allergy. Current Pediatrics. 2015;14(1):70-77. DOI: 10.15690/vsp.v14i1.1265 (In Russian).
21 Greer FR, Sicherer SH, Burks AW, AAP Committee on Nutrition, Section on Allergy and Immunology. The effects of early nutritional interventions on the development of atopic disease in infants and children: the role of maternal dietary restriction, breastfeeding, hydrolyzed formulas, and timing of introduction of allergenic complementary foods. Pediatrics. 2019;143(4):e20190281. DOI: 10.1542 peds.2019-0281
22 Намазова-Баранова ЛС, Вишнёва ЕА, Селимзянова ЛР, Алексеева АА. Введение прикорма и пищевая аллергия: новые исследования и современные клинические рекомендации. Вопросы современной педиатрии. 2017;16(3):196-201. / Namazova-Baranova LS, Vishneva EA, Selimzianova LR, Makarova SG, Alekseeva AA. Introduction of complementary foods and food allergies: new studies and modern clinical guidelines. Current Pediatrics. 2017;16(3):196-201. DOI: 10.15690/vsp.v16i3.1729 (In Russian).
23 Строкова ТВ, Таран НН, Титова ОН, Павловская ЕВ, Матинян ИА, Багаева МЭ, и др. Оценка пищевого статуса у детей с гастроинтестинальной формой пищевой аллергии. Вопросы детской диетологии. 2020;18(2):5-14. / Strokova TV, Taran NN, Titova ON, Pavlovskaya EV, Matinyan IA, Bagaeva ME, et al. Assessment of nutritional status in children with gastrointestinal form of food allergy. Vopr. det. dietol. (Pediatric Nutrition). 2020;18(2):5-14. DOI: 10.20953/ 1727-5784-2020-2-5-14 (In Russian).
24 Макарова СГ, Емельяшенков ЕЕ, Фисенко АП, Мурашкин НН, Вершинина МГ, Семикина ЕЛ, и др. Антропометрические показатели и нутритивный статус детей с тяжелой формой атопического дерматита и пищевой аллергией. Вопросы детской диетологии. 2022;20(5):16-26. / Makarova SG, Emelyashenkov EE, Fisenko AP, Murashkin NN, Vershinina MG, Semikina EL, et al. Anthropometric parameters and nutritional status in children with severe atopic dermatitis and food allergy. Vopr. det. dietol. (Pediatric Nutrition). 2022;20(5): 16-26. DOI: 10.20953/1727-5784-2022-5-16-26 (In Russian).
25 Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, et al; European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021 Jul; 32(5):843-858. DOI: 10.1111/pai.13496
26 Abrams EM, Watson W, Vander Leek TK, Atkinson A, Primeau MN, Francoeur MJ, et al. Dietary exposures and allergy prevention in high-risk infants. Allergy Asthma Clin Immunol. 2022 Apr 30;18(1):36. DOI: 10.1186/s13223-021-00638-y
27 Bellach J, Schwarz V, Ahrens B, Trendelenburg V, Aksünger Ö, Kalb B, et al. Randomized placebo-controlled trial of hen's egg consumption for primary prevention in infants. J Allergy Clin Immunol. 2017 May;139(5):1591-1599.e2. DOI: 10.1016/j.jaci.2016.06.045
28 Palmer DJ, Metcalfe J, Makrides M, Gold MS, Quinn P, West CE, et al. Early regular egg exposure in infants with eczema: A randomized controlled trial. J Allergy Clin Immunol. 2013 Aug;132(2):387-92.e1. DOI: 10.1016/j.jaci.2013.05.002
29 Ierodiakonou D, Garcia-Larsen V, Logan A, Groome A, Cunha S, Chivinge J, et al. Timing of Allergenic Food Introduction to the Infant Diet and Risk of Allergic or Autoimmune Disease: A Systematic Review and Meta-analysis. JAMA. 2016 Sep 20;316(11):1181-1192. DOI: 10.1001/jama.2016.12623
30 Perkin MR, Logan K, Tseng A, Raji B, Ayis S, Peacock J, et al; EAT Study Team. Randomized Trial of Introduction of Allergenic Foods in Breast-Fed Infants. N Engl J Med. 2016 May 5;374(18):1733-43. DOI: 10.1056/NEJMoa1514210
31 Rosendahl J, Pelkonen AS, Helve O, Hauta-Alus H, Holmlund-Suila E, Valkama S, et al. High-Dose Vitamin D Supplementation Does Not Prevent Allergic Sensitization of Infants. J Pediatr. 2019 Jun;209:139-145.e1. DOI: 10.1016/j.jpeds.2019.02.021
32 Palmer DJ, Sullivan T, Gold MS, Prescott SL, Heddle R, Gibson RA, et al. Randomized controlled trial of fish oil supplementation in pregnancy on childhood allergies. Allergy. 2013;68(11):1370-1376. DOI: 10.1111/all.12233.
33 Plummer EL, Chebar Lozinsky A, Tobin JM, Uebergang JB, Axelrad C, Garland SM, et al; ProPrems Study Group. Postnatal probiotics and allergic disease in very preterm infants: Sub-study to the ProPrems randomized trial. Allergy. 2020 Jan; 75(1):127-136. DOI: 10.1111/all.14088
34 Dissanayake E, Tani Y, Nagai K, Sahara M, Mitsuishi C, Togawa Y, et al. Skin Care and Synbiotics for Prevention of Atopic Dermatitis or Food Allergy in Newborn Infants: A 2 × 2 Factorial, Randomized, Non-Treatment Controlled Trial. Int Arch Allergy Immunol. 2019;180(3):202-211. DOI: 10.1159/000501636
35 Lowe A, Su J, Tang M, Lodge CJ, Matheson M, Allen KJ, et al. PEBBLES study protocol: a randomised controlled trial to prevent atopic dermatitis, food allergy and sensitisation in infants with a family history of allergic disease using a skin barrier improvement strategy. BMJ Open. 2019 Mar 13;9(3):e024594. DOI: 10.1136/bmjopen-2018-024594
36 Kelleher MM, Phillips R, Brown SJ, Cro S, Cornelius V, Carlsen KCL, et al. Skin care interventions in infants for preventing eczema and food allergy. Cochrane Database Syst Rev. 2022 Nov 14;11(11):CD013534. DOI: 10.1002/14651858. CD013534.pub3
37 Fiocchi A, Schunemann H, Ansotegui I, Assa'ad A, Bahna S, Canani RB, et al. The global impact of the DRACMA guidelines cow's milk allergy clinical practice. World Allergy Organ J. (2018) 11:2. DOI: 10.1186/s40413-017-0179-7.
38 Urashima M, Mezawa H, Okuyama M, Urashima T, Hirano D, Gocho N, et al. Primary prevention of cow’s milk sensitization and food allergy by avoiding supplementation with cow’s milk formula at birth. JAMA Pediatrics. 2019; 173(12):1137. DOI:10.1001/jamapediatrics.2019.3544
39 Макарова СГ, Лаврова ТЕ, Вишнёва ЕА, Турти ТВ, Акоев ЮС, Петровская МИ. Первичная профилактика как эффективный ответ на эпидемию аллергических болезней. Педиатрическая фармакология. 2015;12(1):67-73. / Makarova SG, Lavrova TE, Vishnyova EA, Turti TV, Akoyev YuS, Petrovskaya MI. Primary prevention as an effective response to the epidemic of allergic diseases. Pediatric Pharmacology. 2015;12(1):67-73. DOI: 10.15690/pf.v12i1.124917.
40 Fleischer DM, Spergel JM, Assa’ad AH, Pongracic JA. Primary prevention of allergic disease through nutritional interventions. J Allergy Clin Immunol Pract. 2013;1(1):29–36. DOI: 10.1016/j.jaip.2012.09.003..
41 Osborn DA, Sinn JK, Jones LJ. Infant formulas containing hydrolysed protein for prevention of allergic disease. Cochrane Database Syst Rev. 2018;10(10): CD003664. DOI: 10.1002/14651858.CD003664.pub6.
42 Boyle RJ, Ierodiakonou D, Khan T, Chivinge J, Robinson Z, Geoghegan N, et al. Hydrolysed formula and risk of allergic or autoimmune disease: systematic review and meta-analysis. BMJ. 2016 Mar 8;352:i974. DOI: 10.1136/bmj.i974
43 Mastrorilli C, Santoro A, Caffarelli C. Primary Prevention of Allergic Diseases: The Role of Early Exposure to Cow's Milk Formula. Front Pediatr. 2020 Jul 28;8:420. DOI: 10.3389/fped.2020.00420
44 Lachover-Roth I, Cohen-Engler A, Furman Y, Shachar I, Rosman Y, Meir-Shafrir K, et al. Early, continuing exposure to cow's milk formula and cow's milk allergy: The COMEET study, a single center, prospective interventional study. Ann Allergy Asthma Immunol. 2023 Feb;130(2):233-239.e4. DOI: 10.1016/j.anai.2022.10.013
45 European Comission. Commission Directive 2013/46/EU of 28 August 2013 amending Directive 2006/141/EC with regard to protein requirements
46 Захарова ИН, Цуцаева АН, Климов ЛЯ. Особенности функционального состава козьего молока и его значение в качестве основы для детских смесей. Медицинский совет. 2022;(12):58-63. / Zakharova IN, Tsutsaeva AN, Klimov LYa. Features of the functional composition of goat's milk and its importance as the basis for infant formula. Meditsinskiy sovet (Medical Council). 2022;(12):58-63. DOI: 10.21518/2079-701X-2022-16-12-58-63 (In Russian).
47 Боровик ТЭ, Семёнова НН, Лукоянова ОЛ, Звонкова НГ, Бушуева ТВ, Степанова ТН, и др. Эффективность использования адаптированной смеси на основе козьего молока в питании здоровых детей первого полугодия жизни: результаты многоцентрового проспективного сравнительного исследования. Вопросы современной педиатрии. 2017;16(3):226-233. / Borovik TE, Semyonova NN, Lukoyanova OL, Zvonkova NG, Bushueva TV, Stepanova TN, et al. Efficiency of using the adapted goat’s milk formula in the diet of healthy young infants: a multicenter prospective comparative study. Current Pediatrics. 2017;16(3):226-233. DOI: 10.15690/vsp.v16i3.1733 (In Russian).
48 Prosser CG. Compositional and functional characteristics of goat milk and relevance as a base for infant formula. J. Food Sci. 2021, 86, 257–265. DOI: 10.1111/ 1750-3841.15574.
49 Fiocchi A, Brozek J, Schu H, Ebisawaet M, Schünemann H. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow’s Milk Allergy (DRACMA) Guidelines. Pediatr. Allergy Immunol. 2010, 21, 1–125. DOI: 10.1097/ WOX.0b013e3181defeb9
50 Захарова ИН, Холодова ИН, Нечаева ВВ. Смеси на основе козьего молока: есть ли преимущества? Медицинский совет. 2016;(16):22-26. / Zakharova IN, Kholodova IN, Nechaeva VV. Goat milk infant formula: are there benefits? Meditsinskiy sovet (Medical Council). 2016;(16):22-26. doi: 10.21518/2079- 701X-2016-16-22-26 (In Russian).
51 Денисова СН, Сенцова ТБ, Белицкая МЮ. Оценка клинико-иммунологической эффективности комплексной терапии у детей первого года жизни с атопическим дерматитом. Российский аллергологический журнал. 2013;10(5): 69-74. / Denisova SN, Sentsova TB, Belitskaya MYu. Assessment of clinicalimmunological clinicalimmunological effectiveness of complex therapy of infant atopic dermatitis.Russian Journal of Allergy. 2013;10(5):55-60. DOI: 10.36691/RJA633 (In Russian).
52 Hui-Fang Kao, Yu-Chin Wang, Hsiu-Ying Tseng, Lawrence Shih-Hsin Wu, Hui‑Ju Tsai, Miao-Hsi Hsieh, et al. Goat Milk Consumption Enhances Innate and Adaptive Immunities and Alleviates Allergen-Induced Airway Inflammation in Offspring Mice. Front Immunol. 2020;11:184. DOI: 10.3389/fimmu.2020.00184
53 Zenebe T. Review on medicinal and nutritional values of goat milk. Acad J Nutr. 2014;3:30-9. DOI: 10.5829/idosi.ajn.2014.3.3.93210
54 Lara-Villoslada F, Olivares M, Jimenez J, Boza J, Xaus J. Goat milk is less immunogenic than cow milk in a murine model of atopy. J Pediatr Gastroenterol Nutr. 2004;39:354-60. DOI: 10.1097/00005176-200410000-00010
55 Albenzio M, Campanozzi A, D'Apolito M, Santillo A, Pettoello Mantovani M, Sevi A. Differences in protein fraction from goat and cow milk and their role on cytokine production in children with cow's milk protein allergy. Small Ruminant Research. 2012;105:202-205. DOI: 10.1016/j.smallrumres.2012.02.01
56 Etzold S, Bode L. Glycan-dependent viral infection in infants and the role of humanmilk oligosaccharides. Curr Opin Virol. 2014;7:101-107. DOI: 10.1016/j.coviro. 2014.06.005
57 Giorgio D, Di Trana, A, Claps S. Oligosaccharides, polyamines and sphingolipids in ruminant milk. Small Ruminant Research. 2018;160:23-30. DOI: 10.1016/j. smallrumres.2018.01.006
58 Leong A, Zhiqian Liu Z, Almshawit H, Zisu B, Pillidge C, Rochfort S, et al. Oligosaccharides in goats' milk-based infant formula and their prebiotic and antiinfection properties. Br J Nutr. 2019 Aug 28;122(4):441-449. DOI: 10.1017/ S000711451900134X
59 van Leeuwen SS, te Poele EM, Chatziioannou AC. Goat Milk Oligosaccharides: Their Diversity, Quantity, and Functional Properties in Comparison to Human Milk Oligosaccharides. J Agric Food Chem. 2020;68:13469-13485. DOI: 10.1021/acs. jafc.0c037661017/S000711451900134X
60 Холодова ИН, Киселева ЕС, Нечаева ВВ. Влияние детских молочных смесей, обогащенных длинноцепочечными жирными кислотами и лютеином, на формирование центральной нервной системы и зрения с позиций пищевого программирования. Лечащий врач. 2022;10(25):48-54. / Kholodova IN, Kiseleva ES, Nechaeva VV. Effect of infant formula enriched with long-chain fatty acids and lutein on the formation of the central nervous system and vision from the standpoint of nutritional programming. Lechaschi vrach. 2022;10(25):48-54. DOI: 10.51793/OS.2022.25.10.008 (In Russian).
61 Goehring KC, Marriage BJ, Oliver JS, Wilder JA, Barrett EG, Buck RH. Similar to Those Who Are Breastfed, Infants Fed a Formula Containing 2'-Fucosyllactose Have Lower Inflammatory Cytokines in a Randomized Controlled Trial. J Nutr. 2016 Dec;146(12):2559-2566. DOI: 10.3945/jn.116.236919.
62 Rahman T, Sarwar PF, Potter C, Comstock SS, Klepac-Ceraj V. Role of human milk oligosaccharide metabolizing bacteria in the development of atopic dermatitis/ eczema. Front Pediatr. 2023 Mar 20;11:1090048. DOI: 10.3389/fped.2023.1090048. eCollection 2023
63 Sprenger N, Odenwald H, Kukkonen AK, Kuitunen M, Savilahti E, Kunz C. FUT2- dependent breast milk oligosaccharides and allergy at 2 and 5 years of age in infants with high hereditary allergy risk. Eur J Nutr. 2017 Apr;56(3):1293-1301. DOI: 10.1007/s00394-016-1180-6